Clo là nguyên tố Halogen tiêu biểu và quan trọng nhất, Clo có lẽ là cái tên khá quen thuộc đối với hầu hết chúng ta, Từ khi còn ngồi trong ghế nhà trường cho đến lúc bước ra cuộc sống thường ngày. Vậy bạn có nhớ những điều liên quan về chất hóa học CLO này không? Vậy clo có tính chất vật lý và tính chất hóa học gì. Clo có độc không, clo có những ứng dụng và chế biến bằng cách nào? thì chúng ta cùng nhau tìm hiểu bài viết dưới đây nhé :
Clo là gì?
Clo là một nguyên tố hóa học thuộc chu kì 3 của bảng tuần hoàn, ký hiệu là Cl. Clo trong tự nhiên thường tồn tại dưới dạng nguyên tử ion clorua (Cl-). Nó khá phổ biến trong đời sống khi kết hợp với các nguyên tố khác tạo thành muối NaCl, hoặc các hợp chất khác. Các clorua này chính là thành phần tạo ra muối hòa tan trong biển, chiếm 1,9% khối lượng của nước biển hiện nay

Clo tồn tại ở 2 dạng đó là dạng lỏng và dạng khí.
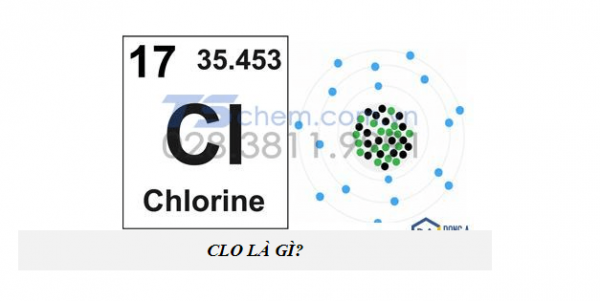
Nhóm, phân lớp 17, p
Số nguyên tử bằng 17.
Phân loại là Halogen.
Cấu hình electron [Ne] 3s2 3p5.
Mỗi lớp chứa 2 7 8 e
Khối lượng nguyên tử chuẩn 35.453(2) g
Cấu trúc tinh thể :

Tính chất của Clo :
Tính chất vật lý của clo
Định nghĩa Clo là gì đã được giải đáp ở trên. Vậy Clo tồn tại ở trạng thái nào? Câu trả lời là Clo thường tồn tại ở dạng khí hoặc dạng lỏng.
Clo là chất khí có màu gì? Khí Clo độc như thế nào? Clo ở thể khí có màu vàng đục, mùi rất hắc, khó ngửi trong điều kiện thường và rất độc hại, cần phải mang đồ bảo hộ nếu tiếp xúc trực tiếp. Công thức Clo là Cl2, khối lượng = 71 đvC nên nặng hơn so với không khí (32 đvC) khoảng 2.5 lần.
Khí clo có thể tan trong nước tạo thành nước clo hoặc tan trong nhiều dung môi hữu cơ khác. Ví dụ như 1 lít nước có thể hòa tan 3,1 lít khí clo ở nhiệt độ 10 độ C, còn ở 30 độ C thì hòa tan được chỉ 1,77 lít khí clo. Ngoài ra, khí clo còn phản ứng rất nhanh nhạy với nhiều nguyên tố khác.

Clo là chất khí có màu gì? Khí clo độc như thế nào? Clo dạng lỏng hoặc dạng khí đều có màu vàng nhạt và rất độc nếu dùng ở liều lượng cao.
Ở nhiệt độ phòng với áp lực trên 8 atm, khí clo có thể hóa lỏng. Clo thể lỏng tồn tại độc lập hoặc kết hợp với các thành phần trong chất lỏng đó để tạo thành những hợp chất của Clo mang nhiều ứng dụng. Ví dụ trong sản xuất, người ta thường điều chế nước Javen là dung dịch bao gồm NaCl, NaClO và H2O với khả năng tẩy rửa cực mạnh.
Tính chất hóa học của clo
Xét về tính chất hóa học của Clo, clo là một phi kim nên có khả năng oxy hóa mạnh mẽ. Do đó, người ta thường kết hợp Clo với nhiều chất khác để tạo ra hợp chất mang nhiều lợi ích.
Trong những hợp chất này, Clo mang mức oxi hóa -1, trong hợp chất với F hoặc O Clo mang mức oxi hóa +1, +3, +5 hay +7. Sau đây là 4 phản ứng điều chế ứng dụng clo thường dùng nhất trong đời sống.
Clo tác dụng với kim loại tạo thành muối Clorua. Clo có thể tác dụng với hầu hết kim loại ngoại trừ Au và Pt.
Mg +Cl2 –> MgCl2
2Na + Cl2 → 2NaCl
Clo tác dụng với Natri Hiđroxit NaOH tạo dung dịch nước Javen cho tẩy rửa.
Cl2 + 2NaOH → NaCl + NaClO + H2O
Clo tác dụng với nước tạo thành HCl và HClO (nước Clo). Đây là phản ứng 2 chiều.
H2O + Cl2 –> HCl + HClO
Clo tác dụng với Hidro, tạo thành hợp chất khí Hidro Clorua mang tính axit khá độc.
H2 + Cl2 –> 2HCl
Trạng thái tự nhiên :
Trong tự nhiên, clo có hai đồng vị bền là 35Cl (75,77%) và 37Cl (24,23%), nguyên tử khối trung bình là 35,5.
Do hoạt động hoá học mạnh nên nguyên tố clo chỉ tồn tại trong tự nhiên ở dạng hợp chất, chủ yếu là muối natri clorua có trong nước biển và muối mỏ. Một lít nước biển chứa khoảng 30 g muối natri clorua. Hợp chất khác của clo cũng phổ biến trong tự nhiên như chất khoáng cacnalit KCl.MgCl2.6H2O. Axit clohiđric cũng có trong dịch vị dạ dày của người và động vật. Trong nước biển, clo chiếm khoảng 2% khối lượng.
Ứng dụng của clo trong đời sống sản xuất
Sau khi hiểu được Clo là gì và tính chất của clo, chúng ta hãy cùng tìm hiểu những ứng dụng của Clo trong công nghiệp và đời sống thường ngày.
Vậy cụ thể tác dụng của Clo trong sản xuất và đời sống là gì? Tác dụng phổ biến của clo có thể kể đến là: sản xuất công nghiệp, điều chế chất tẩy rửa, khử trùng hồ bơi và làm sạch nước sinh hoạt.

– Nước Clo dùng để khử trùng nước ở bể bơi, hồ bơi:
Có thể thấy, cơ chế diệt vi khuẩn trong nước bể bơi, hồ bơi của nước Javen khá đơn giản, bằng cách châm nước Javen vào bể bơi, dung dịch sẽ phân hủy tạo ra axit hypoclorơ (HOCl) và ion hypoclorit (OCl-). Hai chất này tấn công vào các lipid của thành tế bào các vi sinh vật, vi khuẩn rồi phá hủy các enzym và các cấu trúc bên trong tế bào khiến chúng bị oxi hóa, vô hại từ đó không thể phát triển và chết dần. Điều này giúp tránh gây ô nhiễm trong môi trường hồ bơi, bể bơi – nơi có đông người sử dụng.
Sau khi hoàn tất quá trình khử trùng và làm sạch nước ở bể bơi, hồ bơi, HOCl và OCl- sẽ kết hợp với các hóa chất trong bể bơi khác có Nitơ hay Amoniac hoặc tự chia thành các nguyên tử đơn và mất đi hoạt tính. Tốc độ này sẽ tăng khi gặp ánh sáng mặt trời, đây là lý do mà người ta thường xử lý nước bằng Clo vào buổi chiều.
– Nước Clo được dùng để làm tinh khiết nước trong sinh hoạt:
Với đặc tính oxi hóa mạnh của nguyên tử [O], nước Clo được xem là giải pháp hữu hiệu để khử trùng, làm sạch, làm tinh khiết nước dùng trong sinh hoạt hằng ngày, kể cả nước uống đóng bình hiện nay.
– Nước Clo được dùng để tẩy trắng quần áo:
Trong cuộc sống của chúng ta chắc hẳn ai cũng từng trải qua cảm giác buồn khi chiếc áo, chiếc quần mình yêu thích bị vàng ố hay bị vết bẩn khó phai, và trong những lúc này nước Clo sẽ giúp bạn giải quyết nỗi lo đó. HClO là chất oxi hóa mạnh nên nước Clo có tính tẩy màu rất tốt, giúp đánh bay vết bẩn cứng đầu nhất.
– Clo được sử dụng trong sản xuất công nghiệp:
Clo được sử dụng rộng rãi trong sản xuất giấy, khử trùng, thuốc nhuộm, thực phẩm, thuốc trừ sâu, sơn, sản phẩm hóa dầu, chất dẻo, dược phẩm, dệt may, dung môi và nhiều sản phẩm tiêu dùng khác.
Ngoài ra, Clo cũng được sử dụng trong sản xuất các muối clorat, clorofom, cacbon tetraclorua và trong việc chiết xuất brom.
Điều chế :
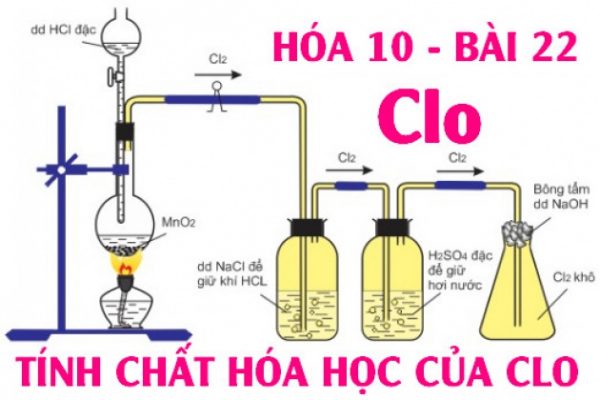
1. Điều chế Clo trong phòng thí nghiệm
– Dùng chất oxihóa mạnh như MnO2, KMnO4, KClO3 ,… tác dụng dung dịch HCl đặc hoặc muối Clorua
MnO2 + 4HCl → MnCl2 + Cl2 + H2O
2KMnO4 + 16HCl → 2MnCl2 + 2KCl + 5Cl2 + 8H2O
2. Điều chế Clo trong công nghiệp
– Điện phân dung dịch NaCl có màng ngăn bằng xốp với điện cực dương bằng than chì và điện cực âm làm bằng sắt.
![]()
Bài tập vận dụng :
Bài 1 : Cần bao nhiêu gam KMnO4 và bao nhiêu ml dung dịch axit clohiđric 1M để điều chế khí clo tác dụng với sắt, tạo nên 16,25g FeCl3?
lời giải :
– Theo bài ra, ta có: nFeCl3 = m/M = 16,25/162,5 = 0,1 (mol)
– Phương trình hóa học của phản ứng:
3Cl2 + 2Fe → 2FeCl3
Theo PTPƯ: nCl2 = (3/2).nFe = (3/2).0,1 = 0,15 (mol)
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Theo PTPƯ: nKMnO4 = (2/5).nCl2 = (2/5).0,15 = 0,06 (mol)
nHCl = (16/5).nCl2 = (16/5).0,15 = 0,48 (mol).
mKMnO4 cần = 0,06. 158 = 9,48 (g).
⇒ Vdd HCl = n.CM = 0,48.1 = 0,48 (lít).
Xem thêm : Tính chất hóa học của nước, nước tác dụng với những chất nào